Mekanisme reaksi subtitusi kedua dan ketiga dan hubungannya dengan persamaan hammet
Reaksi Subtitusi kedua dan ketiga
Benzena adalah hidrokarbon aromatik (cincin konjugat) yang bersifat tidak jenuh.Benzena merupakan sikloheksena yaitu senyawa siklik yang memiliki ikatan rangkap dua aromatik dengan rumus struktur C6H12. Benzena dilambangkan dalam dua bentuk, yang pertama adalah struktur Kekulé dan yang lainnya adalah heksagon dengan lingkaran di dalamnya untuk menggambarkan adanya resonansi ikatan ʋ atau distribusi elektron yang tersebar merata didalam cincin benzena.
Substituen adalah cabang yang berikatan dengan cincin benzena. Aturan penamaan IUPAC turunan benzena 1 substituen secara umum adalah cincin benzena merupakan rantai utama, sedangkan subtituen dianggap sebagai cabang.
Kaidah reaksi subtituen banyak pada benzena
Teori Substitusi Elektrofilik pada Senyawa Aromatik
1. Kereaktifan inti aromatik
Inti benzena yang mengikat gugus pengaktif akan bereaksi lebih cepat dalam subtitusi elektrofilik daripada benzena, sedangkan yang mengikat gugus pendeaktif akan bereaksi lebih lambat. Reaksi yang melewati keadaan transisi lebih stabil (Ea lebih rendah) berlangsung lebih cepat daripada reaksi yang melewati keadaan transisi yang kurang stabil (Ea lebih tinggi). Langkah penentu laju reaksi pada sebagian besar reaksi subtitusi elektrofilik pada benzena yang tersubtitusi adalah langkah yang mengahsilkan ion benzenonium. Jika substituen dinyatakan dengan S, maka ion benzenonium yang terbentuk oleh serangan elektrofil E+ dapat dituliskan sebagai berikut :
Dengan cara penulisan tersebut diatas berarti bahwa S dapat berposisi orto, meta atau para terhadap elektrofil E. Laju reaksi yang diakibatkan oleh adanya S tergantung apakah S menarik atau mendorong elektron. Jika S gugus pendorong elektron maka reaksi berlangsung lebih cepat daripada benzena. Sebaliknya jika S gugus penarik elektron maka reaksi berjalan lebih lambat.
2. Teori Orientasi
Efek induksi adalah efek yang diakibatkan oleh perbedaan keelektronegatifan antara dua atom atau gugus. Contohnya, atom halogen lebih elektronegatif daripada atom karbon sehingga halogen memberikan efek induksi menarik elektron. Disamping itu terdapat gugus-gugus lain yang memberikan efek induksi karena adanya muatan positif atau parsial positif pada atom yang terikat pada inti benzena.
Mekanisme Reaksi subtitusi elektrofilik
Pengarah orto
Pengarah Meta
Pengarah Para
Yang mempengaruhi dari kestabilannya adalah bergantung kepada hasil dari karbokation yang terbentuk pada posisi tersier yang akan membuat hasil lebih banyak dibandingkan pada posisi meta
Aturan penamaan benzena 2 substituen:
Kaidah Reaksi subtitusi kedua Benzena
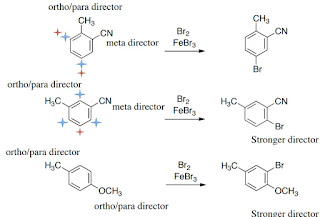
Substituen pertama pada benzena mempengaruhi tempat substitusi kedua.
Pada kaidah ini Kestabilannya berbeda tergantung penempatan karbokation
P
1. Pengarah Orto/Para
Gugus pada cincin akan mengarahkan substituen yang baru masuk pada posisi orto, para atau meta sesuai dengan gugus mulanya. Gugus mula tersebut yang disebut sebagai penentu orientasi. Gugus yang merupakan activator kuat adalah gugus pengarah orto, para (adisi elektrofilik mengambil tempat pada posisi orto dan para bergantung pada activator). Orientasi ini terutama disebabkan oleh kemampuan substituen pengaktif kuat untuk melepaskan elektron (gugus amino dan gugus hidoksil merupakan gugus activator yang baik). Substituen pengarah orto dan para adalah substituen pemberi elektron atau yang memiliki pasangan elektron bebas.
2.Pengarah Meta
Suatu pengarah meta mempunyai atom bermuatan positif atau sebagian positif yang terikat pada cincin benzena. Dalam reaksi nitrobenzena, gugus nitronya tidak menambah kesetabilan intermedietnya. Malahan intermediet substitusi orto, atau para dan keadaan transisinya kurang stabil (karena energy yang tinggi), karena sebuah struktur resonansi mengandung muatan positif pada atom berdekatan. Oleh karena itu, substitusi terjadi lebih banyak pada tempat meta, sebab keadaan transisi dan intermediatnya pada tempat yang berdekatan mengandung muatan positif.Substituen pengarah meta adalah substituen penarik elektron atau yang tidak memiliki pasangan elektron bebas.
Penamaan Subtituen ketiga
Aturan penamaan benzena >2 substituen:
1) Substituen prioritas menjadi rantai utama bersama cincin benzena.
2) Substituen lain dianggap sebagai cabang.
3) Posisi substituen dinyatakan dengan angka.
4) Penomoran cabang dimulai dari atom karbon yang mengikat substituen prioritas tertinggi. Arah penomoran dilakukan ke substituen prioritas berikutnya.
Jika seluruh substituen sama, maka dianggap tidak ada cabang, namun posisi tetap ditulis.
5) Cabang sejenis yang jumlahnya >1 cukup ditulis sekali, namun diberi indeks.
6) Jika terdapat lebih dari satu macam jenis cabang, maka urutan penamaan cabang diurut berdasarkan abjad dalam bahasa Inggris (sebelum diberi indeks).
Kaidah reaksi subtituen banyak pada benzena
1) Efeknya bersifat kumulatif
2) Substituen yang lebih kuat sesuai dengan efek relatif akan menjadi lebih penting untuk mengarahkan efek
3) Bila diberi pilihan, substituen baru biasanya tidak akan berikatan orto kepada dua substituen lainnya
Pada persamaan hammett berpengaruh substituen polar posisi meta atau para terhadap sisi reaksi turunan benzena. Persamaan Hammet tidak berlaku untuk substituen pada posisi orto karena adanya efek sterik begitupun dengan suatu senyawa alifatik. Pada persamaan Hammett biasanya memag berlaku untuk sistem aromatis hanya untuk reaksi – reaksi dimana substituen dan pusat reaksi terisolasi.
Hammet memperkenalkan tetapan substituennya untuk memprediksi tetapan kesetimbangan dan tetapan laju reaksi kimia. Persamaan ini bertujuan menunjukkan hubungan kuantitatif untuk menghitung pengaruh substituen terhadap reaktivitas molekul Persamaan yang digunakan untuk menyatakan nilai efek elektronik ini dirumuskan sebagai berikut :
pK0 – pK = ρσ
Daftar Pustaka
http://www.chm.uri.edu/blucht/chm227/4-22.pdf
https://www.utdallas.edu/~biewerm/17.pdf
https://rizagustia.files.wordpress.com/2012/04/substitusi-benzena1.pdf
https://rizagustia.files.wordpress.com/2012/04/substitusi-benzena1.pdf
Pertanyaan
1.Bagaimana cara menentukan posisi Subtituen kedua pada senyawa ini dibawah?
2.Apa jenis mekanisme pembentukan dari subtituen kedua berdasarkan materi diatas?
3.Berdasarkan hal diatas bagaimana hubungannya dengan hukum hammet pada posisi ortho kenapa tidak berlaku?









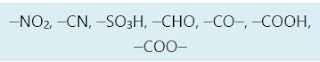





Terimakasih atas pemaparan materi yang sangat bermanfaat , saya akan mencoba menjawab pertanyaan saudara albert yang pertama dimana pada subtituen pertama yaitu NO2 merupakan gugus deaktivasi yang mana produk yang lebih baik condong mengarah ke arah -meta yang mana deaktivasi itu suatu gugus penarik elektron.
BalasHapusHai ALbert saya akan menjawab pertanyaan anda. Menurut saya untuk menentukan substituen keduanya bisa masuk dimana, kita harus ketahui dulu substituen pertamanya . Disini substituen pertamanya adalah CH3, yang tergolong pengarah orto dan para sehingga substituen kedua akan masuk pada posisi orto dan para.
BalasHapusterimakasih
Materi yang menarik Albert, toluena memiliki substituen pertama berupa metil. metil merupakan salah satu contoh gugus pengarah orto para dan termasuk gugus aktivasi. Dari kemampuan substituen pertama, dapat diketahui posisi masuknya substituen kedua. Jadi pada toluena, substituen kedua akan masuk pada posisi orto dan para.
BalasHapusTerima kasih atas materinya
BalasHapusMenurut sya tergantung dari subtituen kedua juga dimana nantinya akan masuk pada posisi orto-para karena CH3 merupakan pengarah orto-para
Materi yang sangat menarik, menurut saya toluena memiliki substituen pertama berupa metil. metil merupakan salah satu contoh gugus pengarah orto para dan termasuk gugus aktivasi. Dari kemampuan substituen pertama, dapat diketahui posisi masuknya substituen kedua. Jadi pada toluena, substituen kedua akan masuk pada posisi orto dan para.
BalasHapusTerimakasih atas penjelasan yang saudara sampaikan sangat bermanfaat
BalasHapusBaiklah disini saya akan mencoba menjawab pertanyaan yang diajukan
Untuk menentukan substituen yang kedua pada senyawa tersebut maka kita harus mengetahui substituen yang pertama dahulu. Pada senyawa tersebut substituen pertamanya yaitu CH3 dimana CH3 termasuk pada pengarah posisi orto-para
Terimakasih :)
terimakasih atas materinya albert;) menurut saya, senyawa Toluena memiliki substituen pertama berupa metil sebagai gugus aktivasi serta toluena juga merupakan salah satu contoh gugus pengarah orto para. Dari kemampuan substituen pertama, dapat diketahui posisi masuknya substituen kedua. Jadi pada toluena, substituen kedua akan masuk pada posisi orto-para. Terimakasih
BalasHapusTerimakasih albert
BalasHapusUntuk pertanyaannya
1. CH3 merupakan contoh gugus aktivator yang akan mengarahkan produk pada posisi orto dan para
Sekian :)
Terimaksih buat materinya
BalasHapusSaya akan menjawab
Menurut saya untuk menentukan posisi substituen kedua terlebih dahulu kita melihat sustituen pertama. Apabila mengrah pada produk maka posisi orto dan para. CH3 merupakan pengarah pada orto dan para karena merupakan gugus aktivator
terima kasih atas materinya, menurut saya prosk akan memiliki orientasi para dan ortho karena gugus metil meerupakan termasuk gugus aktivasi
BalasHapusPosisi orto para. karena ch3 merupakan pengarah orto. Ch3 bisa melepas h+ lalu c kan membuat ikatan rangkp dv cincin sehingga elektron akan terdorong di posisi orto
BalasHapusMenurut saya untuk menentukan substituen keduanya bisa masuk dimana, kita harus ketahui dulu substituen pertamanya . Disini substituen pertamanya adalah CH3, yang tergolong pengarah orto dan para sehingga substituen kedua akan masuk pada posisi orto dan para.
BalasHapusSaya akan mencoba menjawab no 1
BalasHapusMenurut saya toluen adalah gugus pembawa orto, para , sehingga untuk produk subtitusi ke 2 adalah produk orto para